Автор фото, UC Davis Health
Передовая терапия, благодаря которой диагностировали неврологические пороки, лечащиеся еще в утробе матери, может спасти многих детей от редкой страшной болезни. , слегка напрягся при осмотре ее живота. Мишель вспоминает, что он начал вести себя очень странно и задавать хаотические вопросы.
Через несколько дней ей позвонил по телефону главный рентгенолог отделения. С грустью в голосе он сообщил, что ей нужно немедленно обратиться к специалисту по гестационной фетальной медицине, поскольку у ее ребенка редкое неврологическое заболевание – спина бифида, или расщелина позвоночника. , когда спинной мозг, который начинает развиваться у детей как свертывающаяся трубка, чтобы окутать собой центральную нервную систему, не соединяется полностью. Как следствие часть обнаженных нервов образует небольшую выпуклость на позвоночнике. Этот врожденный дефект нервной системы может привести к когнитивным проблемам, а также к хроническому нарушению подвижности и паралича нижней части тела.
“Это было просто ужасно, – вспоминает Мишель из Портленда, штат Орегон. 35 лет. – Я была шокирована”.
Ежегодно в США рождается около 1400 детей с расщелиной позвоночника. В Украине, по данным общественной организации “Сияние духа”, объединяющей родителей детей с расщелиной позвоночника и гидроцефалией, в период с 2006 по 2022 год такой диагноз установили 1344 детей в возрасте до одного года. В то же время за этот же период 91 ребенок в возрасте до одного года с таким диагнозом скончался. Риск появления заболевания повышает недостаточное потребление фолиевой кислоты во время беременности и употребления определенных противосудорожных препаратов, но пока неясно, насколько большую роль это играет. мозг обратно в тело ребенка, предотвращая дальнейшее прогрессирование заболевания.
Однако когда Мишель позвонила по телефону, чтобы записаться на прием к специалисту, медсестра рассказала ей о новой программе в Калифорнии, в пределах которой детей с расщелиной позвоночника лечат с помощью стволовых клеток, пока они еще находятся в утробе матери.
Ей сообщили, что если она решит принять участие в этой программе, ее ребенок станет вторым человеком в мире, который получит такое лечение. Мишель поняла, что это шанс, который он хочет дать своему неродившемуся ребенку.
Процедура должна была состояться до 26-й недели беременности, поэтому для Мишель началась настоящая гонка обследований, анализов крови и собеседований.
<За последние несколько десятилетий пренатальный скрининг на наличие неврологических заболеваний прогрессировал семимильными шагами. Технологии, в частности генетический анализ, нейровизуализация и магнитно-резонансная томография (МРТ), позволяют врачам заглянуть в нервную систему развивающегося плода и раньше и лучше диагностировать у него серьезные заболевания. Но несмотря на такой прогресс, до сих пор врачи мало что могли сделать с этими диагнозами, пока ребенок не выйдет из утробы матери. А значительная часть важного развития мозга происходит задолго до рождения ребенка.
Теперь развитие инновационной внутриутробной нейротерапии может изменить ситуацию. Сейчас проводят несколько начальных испытаний как хирургических, так и медикаментозных методов, позволяющих лечить эти заболевания у младенцев еще до их рождения.
По словам Джеффри Расса, детского невролога из Университета Дьюка, мы стоим на пороге совершенно нового измерения терапии. Он недавно написал академическое эссе, в котором называет внутриутробное лечение “следующей вехой” в неврологии.
Одним из таких передовых методов лечения является клиническое испытание, одобренное американским Управлением по контролю за продуктами и лекарствами (FDA), которое лечит ущелье позвоночника внутриутробно с помощью плацентарных стволовых клеток. Проект, известный как CuRe Trial, стал кульминацией 25 лет работы фетальной хирургини Дианы Ли Фармер из Калифорнийского университета в Дэвисе. В очень сложных случаях расщелины позвоночника стандартным лечением стали внутриутробные операции, во время которых отверстие в спинном мозге зашивают . Они замедляют дегенерацию заболевания в течение беременности и улучшают состояние пациентов больше, чем после родов.
Но новый проект Фармер имеет целью сделать шаг еще дальше. Новая терапия предполагает заклеивание открытой нервной трубы специальным пластырем, усеянным стволовыми клетками из плаценты матери – так называемыми мезенхимальными стромальными клетками, которые получают и культивируют благодаря сложному процессу в течение четырех дней. Эти клетки должны активизироваться и устранять повреждения, имеющиеся на момент установления диагноза.
Эти стволовые клетки “очень умны”, говорит Айдзюн Ван, биоинженер, разработавший эту технологию стволовых клеток для исследования CuRe.
<"Они могут защитить нейроны от уничтожения под влиянием окружающей среды", - говорит он.
Проведение этого эксперимента на ягнятах из спина бифида показало, что после лечения они могли свободно двигаться без какой-либо заметной инвалидности, тогда как без него их задние лапы были бы парализованы. Такие же результаты ученые наблюдали, когда провели процедуру на бульдогах.
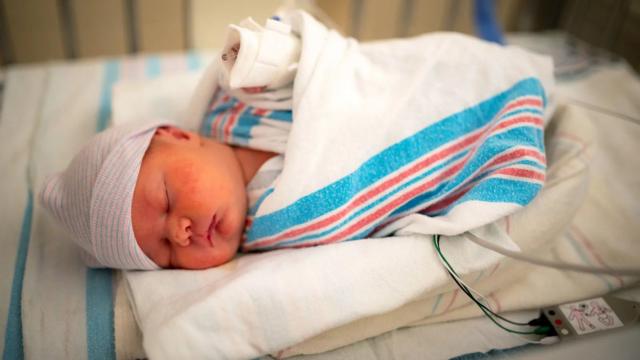
В операционной, где Мишель только за день до истечения 26-недельного срока беременности стала вторым человеком, которому сделали такую операцию, находилось более 30 медиков. На животе сделали разрез, матку почти полностью вынули из тела, а плод подняли к отверстию в матке. Это позволило врачам добраться до грыжи на крошечном позвоночнике ребенка и осторожно наклеить пластырь из стволовых клеток. Для проведения операции врачи использовали специальные микроскопы, поскольку ребенок был очень маленьким.
Если бы ребенка – мальчика, которого назвали Тобиасом, – не вылечили, он родился бы с параличом ног. Однако 1 февраля 2022 года он родился с помощью кесарева сечения с весом 3,5 кг, двигал ногами и шевелил пальцами на них.
“Такое ощущение, будто мы выиграли в лотерею”, – говорит Мишель.
Тобиас должен находиться под наблюдением врачей до 30 месяцев – его последний прием состоится этим летом – после чего можно будет официально утверждать о полной безопасности и эффективности процедуры. Однако врачи, вероятно, будут продолжать наблюдать за ним, пока ему не исполнится по крайней мере пять лет.
На момент написания статьи еще 10 пациентов получили лечение CuRe, и команда Фармер обеспечила финансирование в размере 15 миллионов долларов США для еще 29 пациентов, надеясь лечить около 10 пациентов в год. Только в 2028 году команда Фармер сможет оценить все собранные данные и подтвердить, может ли эта новая терапия стать стандартом для лечения детей по всей стране. , – говорит Фармер. – Но, как и в любом хорошем научном проекте, когда вы отвечаете на один вопрос, это открывает двери для другого вопроса.
Это передовое научное достижение для анатомических заболеваний, которые можно исправить хирургическим путем, говорит Джеффри Расс. Но еще одна сфера, где внутриутробная терапия имеет потенциал изменить ситуацию, – неврологические заболевания у новорожденных детей, терапию которых можно проводить на молекулярном или генетическом уровне. Это “совершенно новая концепция”, которая “откроет целую новую сферу”, говорит Расс.
Его коллеги из Университета Дьюка внесли вклад в разработку протокола для первого в истории внутриутробного лечения болезни Помпе – редкого генетического заболевания, которое заставляет клетки содержать слишком много сложных сахаров, что приводит к неврологическим заболеваниям, проблемам с дыханием и сердцем и мышечной слабости. Большинство пациентов умирают в течение одного-двух лет после рождения.
Поскольку болезнь Помпе вызывает отсутствие фермента под названием кислая альфа-глюкозидаза, ее обычно лечат с помощью заместительной ферментной терапии (ЗФТ), когда дети регулярно получают инъекции фермента. Однако, как и в случае с расщелиной позвоночника, данные показали, что начало ЗФТ сразу после рождения ребенка может облегчить симптомы, но не может полностью остановить проявление болезни. Поэтому в феврале 2021 года врачи Оттавской больницы в Онтарио , Канада, провели исследование нерожденной девочке по имени Айла Башир и обнаружили, что она унаследовала те же гены, через которые двум ее сестрам Зари и Сари поставили диагноз Помпе после рождения – они знали, что нужно действовать быстро. Зара и Сара умерли в возрасте 29 и 8 месяцев соответственно. Но благодаря внутриутробному диагнозу Айлы врачи смогли провести вмешательство раньше.
24 марта 2021 года врачи дали Айле первую дозу ЗФТ – когда она еще была в утробе матери на 24 неделе и пяти днях беременности. Они ввели в пупочную вену жидкую смесь, содержащую копию отсутствующего фермента под названием алглюкозидаза альфа. Такой подход позволяет производимому ферменту проникать в кровоток плода, пока он еще не развивается. Это означает, что он не успевает воспринять препарат как чужеродный для себя и не создает сильного иммунного ответа, который может возникнуть во время лечения после рождения. После этого Айли произвели еще шесть инфузий каждые две недели. Она родилась 22 июня 2021 года, и с тех пор ей еженедельно делают инъекции ферментов. , специалист по лечению матери и плода в больнице Оттавы, которая ее лечила.

Автор фото, CHEO Media House
Подобно Тобиасу, врачи продолжат Айлой не менее пяти лет, чтобы следить за прогрессированием заболевания, поскольку терапия не полностью предотвращает необратимое повреждение органов. Но история Айлы прокладывает путь к созданию дородовых медицинских процедур, которые могут помочь лечить подобные расстройства с помощью простой инъекции. , один из фетальных хирургов Калифорнийского университета в Сан-Франциско, руководившей разработкой протокола, который использовали для лечения Айлы.
Сейчас существует несколько методов лечения новорожденных, которые можно использовать и во время внутриутробной фазы, говорит Маккензи. Она начала пятилетние клинические испытания для 10 пациентов в Калифорнии, чтобы официально одобрить внутриутробную ЗФТ для лечения болезни Помпе и других редких заболеваний, таких как нейронопатическая болезнь Гоше, мукополисахаридоз и болезнь Вольмана.
Двух младенцев с мукополисахаридозом уже лечили в рамках испытания с положительными результатами, говорит Маккензи. Они продолжают привлекать к испытанию новых пациентов, в том числе иностранных.
Разработка фетального лечения подобных состояний также поможет повысить осведомленность о необходимости тестирования генетических заболеваний во время беременности, говорит Маккензи. “Диагноз и лечение – я называю их ень и янь – идут бок о бок”, – говорит она.
И хотя ЗФТ является наименее инвазивным типом лечения генетических расстройств – однако требует многократных доз в течение жизни пациента – этот новый метод можно адаптировать для проведения других терапий – в частности для редактирования ДНК нерожденного ребенка для удаления дефектного гена или замены отсутствующего.
Автор фото, Maurice Ramirez/UCSF
Работа Маккензи “закладывает основу для этих видов прогрессивной терапии в будущем”, говорит Уильям Перанто, профессор хирургии в Детской больнице Филадельфии.
“Если эти испытания смогут продемонстрировать преимущества лечения заболеваний до рождения с помощью заместительной ферментной терапии, тогда очевидным следующим вопросом станет более определяющая терапия, например внутриутробное редактирование генов”.
Во время ряда новаторских экспериментов Перанто использовал технику редактирования генома Crispr, чтобы редактировать генетический код нескольких мышей, еще находящихся в утробе матери, чтобы вылечить их от генетического заболевания кожи, генетического заболевания легких и генетического метаболического расстройства, влияющего на печень грызунов.
На вопрос о том, сколько времени пройдет до проведения редактирования генов на людях, очень сложно ответить, говорит Перанто – “это всегда занимает больше времени, чем мы хотим или ожидаем”. Возможно, речь идет о пяти-десяти годах. “Остается просто выполнять свою работу”, – говорит он.
Поскольку эти испытания набирают обороты, крайне важно рассмотреть этические и практические последствия таких достижений.
“Мы должны начать с конкретных примеров, где очевидно, что преимущества превалируют риски”, – говорит Расс. Конечно, не все заболевания можно и нужно лечить с помощью стволовых клеток, замены ферментов и технологии редактирования генов до рождения.
Сейчас слишком рано говорить о долгосрочных последствиях этих внутриутробных методов лечения. Большинство пациентов, участвовавших в них, до сих пор являются младенцами или очень маленькими детьми. У нас до сих пор нет долгосрочных данных о взрослых пациентах, которые сейчас проходят терапию редактирования генов.
Итак, хотя операции и химические методы лечения, подобные разработанным Фармером и Маккензи, в большинстве своем являются кратковременными процедурами, после того, как врачи отредактируют генетический код нерожденного ребенка, эти изменения и их последствия останутся с ним навсегда.
Важно также то, что внутриутробная терапия является уникальной процедурой с двойным риском и ставками, поскольку она касается и матери, и ее нерожденного ребенка, говорит Расс: “Вы лечите не только одного пациента, вы лечите двоих”./p>
Семья Мишель Джонсон вернулась в Калифорнию через год после процедуры. Она познакомилась с другими матерями, участвовавшими в исследовании CuRe, а персонал больницы принес Тобиасу торт со свечами на празднование его первого дня рождения.
“Это было действительно нечто особенное, – говорит Мишель. – Круг для них сделало полный оборот, чтобы они смогли увидеть всю работу, которую они делают, и встретиться с этим чудо-ребёнком и увидеть, как он здоров и счастлив”.
На момент написания статьи Тобиас уже отпраздновал свой второй день рождения и научился ходить.







